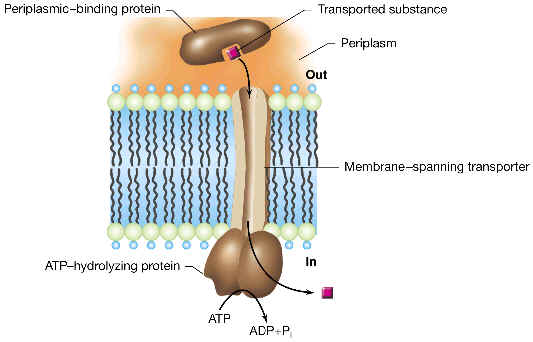
Cuando la endocitosis da lugar a la captura de partículas se denomina fagocitosis, y cuando son solamente porciones de líquido las capturadas, se denomina pinocitosis. La pinocitosis atrapa sustancias de forma indiscriminada, mientras que la endocitosis mediada por receptores sólo incluye al receptor y a aquellas moléculas que se unen a dicho receptor, es decir, es un tipo de endocitosis muy selectivo.
La endocitosis es por ejemplo el método que utilizan las neuronas para recuperar un neurotransmisor liberado en la brecha sináptica, para ser reutilizado. Sin este proceso, se produciría un fracaso en la transmisión del impulso nervioso entre neuronas.
El proceso contrario a la endocitosis es la exocitosis. Endocitosis y exocitosis son dos procesos que están regulados por la célula para mantener constante la membrana plasmática, ya que permiten su regeneración pues los fagosomas que contienen las moléculas fagocitadas se forman a partir de la membrana plasmática y cuando el proceso de digestión celular llevado a cabo por los lisosomas finaliza se lleva a cabo la excreción celular por exocitosis recuperándose la membrana utilizada para la formación del fagosoma.
Pinocitosis es un proceso biológico, que permite a algunas células y organismos unicelulares, obtener líquidos orgánicos del exterior para ingresar nutrientes o para otra función. La endocitosis es la captación de material del espacio extracelular por invaginación de la membrana plasmática. Con desprendimiento hacia el interior celular de una vesícula que contiene líquido con posibles moléculas disueltas o partículas sólidas en suspensión...
La pinocitosis es, junto a la fagocitosis, una modalidad de endocitosis; puede describirse como la endocitosis de porciones de líquido. Se puede observar en células especializadas en la función nutritiva, por ejemplo las de la mucosa intestinal. En esta la membrana se repliega creando una "vesícula pinocítica" y es de esta manera como las grasas, que son insolubles, pasan de la luz del intestino al torrente sanguíneo.
Esta imagen es lo que hace caracteristica a estas dos definiciones.