martes, 23 de agosto de 2011
domingo, 21 de agosto de 2011
tecnicas de tincion de hematoxilina-eosina
La tinción hematoxilina-eosina corresponde a la mezcla de hematoxilina y eosina. La tinción hematoxilina y eosina es uno de los métodos mas populares de tinción utilizado en histología y medicina diagnostica.
El método supone la aplicación de la tinción de hematoxilina, que por ser catiónica o básica, tiñe estructuras ácidas (basófilas) en tonos Azul y Púrpura,como por ejemplo los núcleos celulares; y el uso de eosina que tiñe componentes básicos (acidófilos) en tonos de color rosa, gracias a su naturaleza aniónica o ácida, como el citoplasma.
El método supone la aplicación de la tinción de hematoxilina, que por ser catiónica o básica, tiñe estructuras ácidas (basófilas) en tonos Azul y Púrpura,como por ejemplo los núcleos celulares; y el uso de eosina que tiñe componentes básicos (acidófilos) en tonos de color rosa, gracias a su naturaleza aniónica o ácida, como el citoplasma.
Técnica
- Sumergir los preparados histológicos en xilol para eliminar los excesos de parafina.
- Luego pasan por una serie de alcoholes (100°. 95° y 70°).
- Se lava en agua para eliminar exceso de alcohol
- Se sumerge en hematoxilina por 10 minutos, luego se lava en agua para eliminar excesos y se pasa rápidamente por alcohol ácido.
- Se lava nuevamente
- Se sumerge 30 segundos en eosina.
- Se pasa por otra serie de alcoholes, en orden creciente (70°, 95° y 100°).
- Finalmente se deja remojar 10 minutos en xilol, antes de realizar el montaje final.
Resultados
- Núcleo celular: Azul
- Citoplasma: Rosa
- Musculatura: Rojo , rosa o fucsia
- Glóbulos rojos: Rojo, anaranjado
- Fibrina: Rosa
La tinción de Ziehl-Neelsen (BAAR) es una técnica de tinción diferencial rápida y económica, para la identificación de microorganismos patógenos, por ejemplo M. tuberculosis.
Fue descrita por primera vez por dos médicos alemanes, Franz Ziehl, un bacteriólogo y Friedrich Neelsen, un patólogo.
Esta técnica puede realizarse tanto en muestras histológicas como citológicas.
Fue descrita por primera vez por dos médicos alemanes, Franz Ziehl, un bacteriólogo y Friedrich Neelsen, un patólogo.
Variante histológica
Para demostrar la presencia de BAAR en cortes de tejido en parafina.Los reactivos necesarios para su realización son los siguientes:- ácido periódico 58%
- carbol fucsina de Ziehl (fucsina fenicada). Preparar mezclando en el orden dado:
- 0,5 g fucsina básica
- 50 cc agua destilada
- 5 cc etanol absoluto
- 28,5 g cristales de fenol derretidos
- hematoxilina
- alcohol ácido 1%:
- alcohol de 35º
- ácido clorhídrico
- desparafinar e hidratar los cortes
- ácido periódico 5%, 10 min
- lavar con agua destilada
- fucsina fenicada, 15 min
- decolorar en alcohol ácido al 50%
- lavar con agua destilada
- hematoxilina, 10 min
- azulidificar con, por ejemplo, carbonato de litio
- deshidratar, aclarar y montar preparaciones
Resultados
- BAAR: rojo.
- Núcleos: azul semiamarillo.
Variante clásica o "en caliente"
Ésta y la siguiente variantes son para preparaciones citológicas.- Hacer un frotis de la muestra.
- La fijación al calor asegurará de que el frotis quede adherido al portaobjetos. Un frotis muy delgado puede darle resultados falsamente negativos y un frotis muy grueso puede desprenderse del portaobjetos durante la tinción.
- Utilizando pinzas, coloque los portaobjetos en una gradilla de tinción con los extendidos hacia arriba. Nunca tiña más de 12 portaobjetos a la vez.
- Dejar el frotis sobre el puente de tinción.
- Aplicar fucsina-fenicada.
- Deje que el colorante permanezca sobre los portaobjetos durante 5 minutos. Mantenga el calor durante este período.
- Calentar con un mechero hasta la emisión de vapores (3-5 minutos).
- Se requiere el tiempo adecuado para que la fucsina fenicada penetre y tiña la pared celular de la bacteria. No deje que hierva o se seque el colorante.
- Lave suavemente el colorante de cada portaobjetos con agua corriente fría hasta que toda la tinción libre quede lavada. Lave suavemente de manera que el extendido no se barra del portaobjetos. Retire el exceso de agua.
- Decolorar con alcohol-ácido.
- Cubra cada portaobjetos con la solución decolorante, tal como alcohol ácido y manténgalo sobre el portaobjetos durante 7 minutos. Si no se decolora suficientemente, el contenido del esputo que no son bacilos TBC puede permanecer teñido. Enjuague con agua una vez más los portaobjetos y quite el exceso de agua. Si los portaobjetos aún están rosa, aplique una cantidad adicional de la solución decolorante de 1 a 3 minutos.
- Aplicar azul de metileno (1 minuto).
- Aplique la solución de contraste, azul de metileno, durante 1 minuto.
- Enjuagar con agua
- Vuelva a enjuagar con un leve chorro de agua e incline cada portaobjetos hasta drenar el exceso de agua. Finalmente, coloque cada portaobjetos en una gradilla a que sequen al aire.
- Ahora coloquele una pequeñita gota de aceite de inmersión y haga la observación al microscopio con 100 x 100
- Hacer un frotis.
- Dejarlo en el puente de tinción.
- Aplicar fucsina-fenicada (solución con fenol y mayor concentración de fucsina).
- Dejar en vasos coplin durante 20 minutos.
- Decolorar con alcohol acido.
- Lavar con agua del grifo.
- Contrastar con azul de metileno
tecnicas de tincion de gram
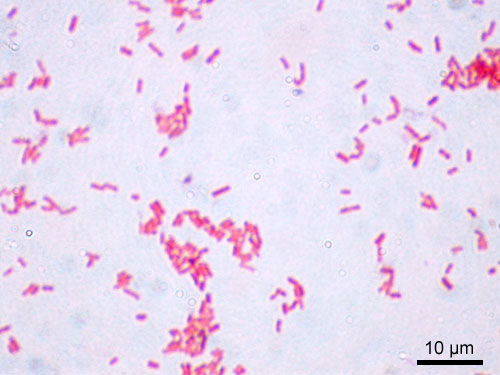
La tinción de Gram o coloración de Gram es un tipo de tinción diferencial empleado en microbiología para la visualización de bacterias, sobre todo en muestras clínicas. Debe su nombre al bacteriólogo danés Christian Gram, que desarrolló la técnica en 1884. Se utiliza tanto para poder referirse a la morfología celular bacteriana como para poder realizar una primera aproximación a la diferenciación bacteriana, considerándose Bacteria Gram positiva a las bacterias que se visualizan de color moradas y Bacteria Gram negativa a las que se visualizan de color rosa o rojo
De esta manera, ya tendremos listo el frotis para su respectiva observación microscópica.
Fijar un frotis
- Con la ayuda de un mechero, flamear un asa bacteriológica y esperar que enfríe un poco.
- Tomar el asa (previamente flameada) y con ésta tomar un poco de muestra.
- Una vez obtenida una pequeña cantidad de la muestra (con el asa), hacer que ésta tenga contacto con una lámina portaobjetos, la cual servirá para depositar la muestra contenida en el asa.
- Con el asa (conteniendo la muestra) sobre la lámina portaobjetos, proceder a realizar la extensión de la muestra en el portaobjetos mediante movimientos giratorios (dar vueltas con el asa) sobre la lámina, de tal forma que al terminar la extensión, tengamos como producto una espiral en la parte media de la lámina.
- Esperar que seque al aire libre o ayudarse con la llama de un mechero para fijar la muestra, teniendo en cuenta que el calor no debe ser directo (sólo se pasa por la llama), puesto que el calor excesivo puede cambiar la morfología celular de las bacterias a observar. El calor deseable es aquél en el que el portaobjetos sea apenas demasiado caliente para ser colocado sobre el dorso de la mano.
Tinción
Con violeta cristal, violeta de genciana, azul de metileno o en todo caso tinta china utilizando una cantidad suficiente de dicho colorante sobre la muestra, como para lograr cubrirla por completo. Se deja actuar al colorante por 1 minuto. Esta tinción de 1 minuto está dada para trabajar a una temperatura ambiente de 25 °C.Enjuague
Al transcurrir el minuto, se debe enjuagar la lámina conteniendo la muestra con agua corriente. Para realizar el lavado, se debe tener en cuenta que el chorro de agua NO debe caer directamente sobre la muestra, ésta debe caer sobre la parte superior de la lámina que no contiene muestra. El chorro debe ser un chorro delgado, aproximadamente de medio a un milímetro de espesor. También el enjuague se debe realizar poniendo la lámina portaobjetos en posición inclinada hacia abajo... La solución de cristal violeta, se recomienda sea al 1%Mordiente
Una vez enjuagado el portaobjetos, se aplica como mordiente yodo o lugol durante 3 minuto más. El mordiente es cualquier sustancia que forme compuestos insolubles con colorantes y determine su fijación a las bacterias.Decoloración
Pasado el minuto de haber actuado el mordiente, el frotis se decolora con etanol al 75 %, etanol al 95 %, acetona o alcohol-acetona, hasta que ya no escurra más líquido azul. Para esto se utiliza el gotero del frasco del decolorante. Se van añadiendo cantidades suficientes del decolorante, hasta lograr que éste salga totalmente transparente, es decir, hasta que ya no escurra más líquido azul.Lavado y secado
Lavar con agua para quitar los residuos de decolorante y esperar que seque la lámina al aire libre o con la ayuda de la llama de un mechero de la forma anteriormente descrita.Tinción de contraste
Una vez que la lámina ya secó, procedemos a teñir nuevamente, pero esta vez se va a utilizar un colorante de contraste como por ejemplo la safranina, dejar actuar durante 1 minuto.Nuevo enjuague
Pasado el minuto correspondiente, se procede a enjuagar la lámina con agua, se escurre el agua sobrante y se seca en la forma anteriormente descrita.De esta manera, ya tendremos listo el frotis para su respectiva observación microscópica.
Suscribirse a:
Comentarios (Atom)